זו הפעם הראשונה שבה חוקרים מצליחים לפתח כלים מותאמים אישית למחלות זיהומיות, שעד היום פותחו רק עבור מחלות ספציפיות דוגמת סרטן ואלצהיימר


מחקר
זו הפעם הראשונה שבה חוקרים מצליחים לפתח כלים מותאמים אישית למחלות זיהומיות, שעד היום פותחו רק עבור מחלות ספציפיות דוגמת סרטן ואלצהיימר

מחלה זיהומית היא מצב שבו מיקרואורגניזם (נגיף, חיידק או פרזיט), הצליח לחדור ולהתרבות בגוף האדם, ולגרום לנזק ישיר לתאי הגוף. הנזק לגוף עשוי להיות גם עקיף, כתוצאה מהתגובה של מערכת החיסון כנגד אותו מחולל המחלה (הפתוגן), למשל יצירת דלקת. עד כה עולם המדע חקר את התגובה החיסונית כ'בלוק' אחד, אך צוות מחקר באוניברסיטת אביב הצליח לסווג באמצעות ניסויים וכלים חישוביים שני מרכיבים מרכזיים של התגובה חיסונית שפועלים במהלך מחלה זיהומית קשה. משמעות התגלית היא פתח לעולם רפואה מותאמת אישית בתחום המחלות הזיהומיות ומתן טיפולים יעילים לחולים. כך למשל, במקום להחליט לתת תרופה אחידה לכלל החולים, לדוגמה אנטיביוטיקה מסוג פניצילין, בהתאם לסיווג והיחס בין שני המרכיבים שנמצאו, הרופא יחליט איזו תרופה בדיוק עליו לתת לחולה ובאיזה מינון. זו הפעם הראשונה בה חוקרים מצליחים לפתח כלים מותאמים אישית למחלות זיהומיות, כלים שעד היום פותחו רק עבור מחלות ספציפיות דוגמת סרטן ואלצהיימר.
את המחקר הנחו החוקרים פרופ' עירית גת-ויקס ופרופ' ערן בכרך, בהובלת הדוקטורנטים אופיר כהן וגל ינקוביץ מבית הספר ע"ש שמוניס למחקר ביו-רפואי וחקר הסרטן, בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז. המחקר פורסם בכתב העת היוקרתי “Cell Systems”.
"באוכלוסייה כללית, אנשים יגיבו באופן שונה לזיהומים ולכן קיים צורך בכלים רפואיים שיצביעו כיצד כל אדם צפוי להגיב למחלה זיהומית מסוימת", מסבירה פרופ' גת-ויקס ומרחיבה "עד כה, היו קיימים בעולמות המדע מדדים כלליים ביותר לאפיון מחלות אלו, דוגמת סמנים דלקתיים, חום, בדיקות שתן וכד'. תגובה, שבמדדים אלה תיראה אחידה, יכולה למעשה להתחלק לתגובות שונות בהתמודדות עם גורם המחלה. במקרי קצה, כפי שראינו למשל במגפת הקורונה, התגובה החיסונית של האדם לנגיף יכולה להגיע למצב קטלני, וזיהוי מקדים של תגובתו יכול לסייע לנו להציל חיים. ההתבוננות החדשה שלנו וחלוקת התגובה הדלקתית נתנה לנו את היכולת למצוא מדדים וסמנים חדשים שיש בגופנו, ממש בזרם הדם. משמע, מדגימת דם פשוטה נוכל ללמוד הרבה יותר על מצבו הבריאותי של האדם שחלה, ולתת לו טיפול מקיף יותר בהתאם להתפתחות הזיהום בגופו".
"הצלחנו להתבונן בתגובת מערכת החיסון ברזולוציה עמוקה, ולזהות שני סוגי תגובה עיקריים: האחד, בו מערכת החיסון נלחמת בפתוגן שחדר לגוף, והסוג השני, בו מתרחש תיקון הנזקים בגוף 'לאחר המלחמה' בפתוגן. במחקרנו, השתמשנו במודלי מחלה בחיות, בכלים חישוביים, ובמידע שנאסף מאנשים עם סמנים שונים בגופם המהווים אינדיקציה לסוג התגובה לפתוגן", מסביר פרופ' בכרך.
"למעשה, רפואה אישית קיימת היום במחלות 'סדורות' דוגמת סרטן, אך אין כמעט שימוש בכלים של רפואה אישית בתחום המחלות הזיהומיות. אנשים בעלי תגובות קיצוניות להדבקה במיקרואורגניזמים, כדוגמת נגיפים או חיידקים, מצויים כיום בחוסר מענה רפואי הולם. אנו מאמינים שבזכות מחקר זה, רופאים יוכלו לאבחן טוב יותר את מצבו של החולה וכתוצאה מכך להעניק טיפול יעיל שישפר את סיכויי ההחלמה של המטופל. אנו שואפים להמשיך את המחקר ולגלות עוד תת-קבוצות בעלות תגובות שונות בקרב האוכלוסייה, כך שנוכל לעזור לרופאים לדייק את אבחנתם ולתת מענה הולם לחולים", מסכמת פרופ' גת-ויקס.

פרופ' עירית גת-ויקס ופרופ' ערן בכרך

מחקר
הפיתוח החדש יאפשר לפזר ענן קרינה אלקטרומגנטית שיסתיר את כלי הטיס

חוקרים מאוניברסיטת תל אביב פיתחו כלי זעיר בהשראת וירוס הקורונה, שמפזר קרינה אלקטרומגנטית ביעילות. מדובר בכדור קטן עם מערך של שפיצים שדומה מאוד בצורתו לווירוס הקורונה. הוא מודפס במדפסת תלת ממד מפלסטיק ומכוסה בנחושת, ומפזר קרינה ביעילות כך שמבנה אחד קטן יכול לשבש פעילות מכ"ם ולהסתיר מטוס. הפיתוח מבוסס על טכנולוגיות מולטי-דיסציפלינריות שמערבות הדפסה תלת-ממדית, שכבות דקות, בינה מלאכותית ואופטימיזציה טופולוגית, לצד עקרונות מכ"ם בסיסיים. לדברי החוקרים, הפיתוח יוכל לעזור בגזרה הביטחונית והמודיעינית להתחמקות מאיכונים של מכ"מים ואף בשימושי לווין שונים. לדוגמה, ניתן לפתור אתגרי תקשורת עם פמטו-לוויינים שלא יכולים לשאת אנטנה גדולה.
מוץ הוא אמצעי להטעיית מכ"ם שתפקידו להסתיר מטרה אמיתית על ידי יצירת ענן שמפזר קרינה אלקטרומגנטית. כלי טיס או שיט מפזרים כמות גדולה של סיבי מתכת ומייצרים מטרת דמה. מכיוון שמטוס הוא מטרה גדולה, נדרשת כמות עצומה של סיבים שמגבילה את השימוש בשיטה. את הבעיה הזאת החוקרים ניסו לפתור במחקרם. המחקר בוצע במעבדתו של פרופ' פבל גינזבורג מהפקולטה להנדסה ע"ש איבי ואלדר פליישמן ומומן ע"י זרועת חיל הים האמריקאי.
"לטכנולוגיה החדשה שפיתחו יש יישומים רבים", מסביר פרופ' גינזבורג. "המומחיות שלנו היא מבנים אלקטרומגנטיים חכמים לטובת תקשורת אלחוטית. מוץ חכם הוא אחד מהאתגרים העכשוויים בתחום הביטחון. הדבר נובע חלקית מהתקדמות במערכות מכ"ם ומסיבות שונות שהציבור הרחב לא יודע. במעבדתנו קיבלנו פניה ממשרד הביטחון אמריקאי לבצע מחקר בנושא מכיוון שאנו מחזיקים בשיא עולמי בסופר-פיזור. גישות שמשלבות בינה מלאכותית מאפשרות לנו לקבל ביצועי-על שכנראה לא ניתן לקבל אחרת".
לדבריו של פרופ' גינבורג, טכנולוגיות המכ"ם מתפתחות מאד מהר ואפשר לקחת אותן ליישומים שונים. "אני אישית נוטה לחשוב על בעיות שעלולות להופיע בעתיד הקרוב, כגון מעקב אחר רחפנים שבעוד מספר שנים יופיעו במקומות רבים, כגון בערים, למטרות משלוחים. במקרה הזה נצטרך לפתח מערכות מעקב יעילות ולמכ"ם פה יש יתרונות רבים הכוללים אמינות, יעילות ומחיר נמוך. לרחפן יש חתימת מכ"ם קטנה ולכן כדאי לפתח שיטות להגדיל אותה וכך לעזור למכ"ם בזיהוי. הפיתוח הנוכחי הוא קפיצת מדרגה נוספת כיוון שהמבנה הוא רחב סרט וכלל כיווני. הצעד הבא שלנו יהיה לגרום למכ"ם לחשוב שמטרה סטטית זזה ומתקרבת, למרות שהיא לא. האם זה סותר את תורת היחסות? התשובה הקצרה היא 'לא, הכל בסדר', אבל זה כנראה יהיה נושא לשיחה הבאה", הואמ סכם בחיוך.

דומה מאוד בצורתו לווירוס הקורונה. הכדור שיעזור להעלים גופי טיס גדולים ממכ"ם

מחקר
בזאת איששו החוקרים תופעות מדעיות שנחזו עד כה רק באופן תיאורטי

חוקרים מאוניברסיטת תל אביב ומאוניברסיטאות בארה"ב ובגרמניה, הצליחו למדוד בפעם הראשונה מסלולי בוהם (Bohm trajectories) ואת הפוטנציאל הקוונטי (Quantum Potential) במערכת קלאסית, תופעות שנחזו עד היום באופן תיאורטי ונמדדו באופן חלקי בלבד. התגלית המדעית התאפשרה במסגרת מחקר שבחן את דינמיקת ההתפשטות של חבילות של גלי כבידה משטחיים על פני מים, על ידי מדידתם לאורך בריכת גלי מים באורך 18 מטרים. גלים אלה מקיימים את משוואת היסוד של תורת הקוונטים, משוואת שרדינגר, ולכן מאפשרים למדוד תופעות גליות המוכרות מתורת הקוונטים במערכת קלאסית.
צוות החוקרים כולל את מר גאורגי גרי רוזנמן, דוקטורנט מבית הספר לפיזיקה באוניברסיטת תל אביב, פרופ' דניס בונדר מאוניברסיטת טוליין שבארה"ב, פרופ׳ וולפגנג שלייך מאוניברסיטת אולם שבגרמניה, פרופ׳ לב שמר מבית הספר להנדסה מכנית מאוניברסיטת תל אביב ופרופ׳ עדי אריה מבית הספר להנדסת חשמל ומופקד הקתדרה לננו-פוטוניקה ע"ש מרקו ולוסי שאול. המחקר פורסם לאחרונה בכתב העת היוקרתי Physica Scripta.
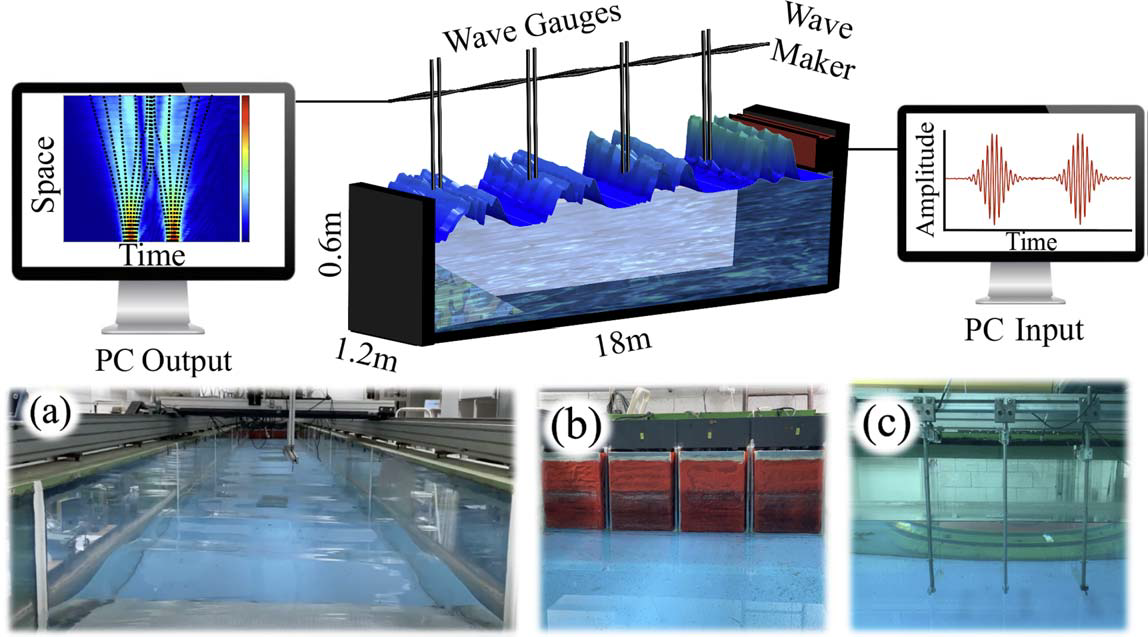
איור 1 - חלק עליון: תיאור סכימטי של המערכת הניסיונית למדידת גלי כבידה משטחיים על פני מים וחילוץ מסלולי בוהם והפוטנציאל הקוונטי. חלק תחתון: (a) צילום חזית של הבריכה בה נוצרים הגלים. (b) מחוללי הגלים הנשלטים על ידי מחשב. (c) חיישנים המודדים את גובה פני המים.
תאוריית דה ברוגלי-בוהם (De Broglie–Bohm theory), הידועה גם בשם מכניקה בוהמית, מתארת את ההתפתחות של פונקציית גל של חלקיק קוונטי במרחב ובזמן על ידי סדרה של מסלולים מוגדרים (הקרויים מסלולי בוהם) שהחלקיק נע באחד מהם. מסלולים אלה נקבעים על ידי משוואת תנועה התלויה בפונקציית הגל ההתחלתית. באופן שקול, ניתן להגדיר פוטנציאל קוונטי שמגדיר את התפתחות פונקציית הגל. התאוריה נקראת על שמם של לואי דה ברוגלי (1892–1987) ודייוויד בוהם (1917–1992) והוצעה על ידם על מנת להסביר את התופעות הנמדדות בפיסיקה קוונטית.

איור 1 - ימין: מדידות ניסיוניות של ניסוי שני הסדקים ומסלולי בוהם שנמדדו (פסים שחורים). המימוש של הסדקים נעשה בתחום הזמן, על ידי יצירת שני פולסים של גלי כבידה משטחיים, בזמנים (t=-4, +4 sec). ניתן לראות את ההתפתחות של מסלולי בוהם לאורך בריכת הגלים (ציר X). יש אזורים שאף מסלול לא חוצה אותם, ועוצמת הגל שתימדד בהם תהיה אפס. הסיבה לכך היא שנוצרת באזורים אלה התאבכות הורסת. לעומתם, יש אזורים שבהם יש צפיפות גבוהה של מסלולי בוהם, ובהם עוצמת הגל מקסימלית (כתוצאה מהתאבכות בונה). איור 2 - שמאל: מראה את הפוטנציאל הקוונטי. הגל נע רק ב'עמקים' (כלומר באזורים שבהם הפוטנציאל נמוך) ולא מגיע ל'הרים' (כלומר לאזורים שבהם הפוטנציאל גבוה).
בעוד שתאוריית דה-ברוגלי-בוהם פותחה עבור תיאור של מערכת קוונטית, הניסוי שבוצע עוסק במערכת קלאסית של גלי כבידה משטחיים על פני מים, אך כאלו שמקיימים את משוואת שרדינגר. לפיכך, צוות החוקרים זיהה כי ניתן ליישם את תאוריית דה ברוגלי-בוהם כדי לבחון באופן נסיוני את מסלולי בוהם ואת הפוטנציאל הקוונטי, אבל בהתקן גדול שניתן לראותו בעין. בניסוי מיוצרים גלי כבידה משטחיים בבריכה באורך של 18 מטרים, שמתנהגים באופן דומה לגלי חומר זעירים בעולם הקוונטי וכך החוקרים הצליחו למדוד במערכת מקרוסקופית תופעות שנחזו במקור למערכות קוונטיות.
בפרט, ניתן לראות בניסוי שחזור מלא של מסלולי בוהם של הניסוי המפורסם של עקיפת חבילת גלים דרך שני סדקים. המימוש של הסדקים נעשה בתחום הזמן על ידי עירור שני פולסים של גלי כבידה משטחיים במישור הכניסה של בריכת הגלים, ולאחר מכן נמדדה ההתפתחות של פונקציית הגל לאורך הבריכה, וממנה נקבעו מסלולי בוהם והפוטנציאל הקוונטי. המערכת הניסיונית שימשה גם למדידת חבילות גלים אחרות כגון חבילת גלים הנוצרת מעקיפה של שלושה סדקים, וחבילת גל שצורתה פונקציית איירי (Airy). מעבר לאישוש התיאוריה של בוהם לגלים קוונטים ומסלולי בוהם, ניסויים אלו פותחים חלון חדש לקראת הבנת הדינמיקה של סוגים שונים של גלים קלאסיים, לרבות גלים אלקטרומגנטיים, פלזמה, אקוסטיים ועוד. מסלולי בוהם מאפשרים להמחיש בצורה ויזואלית כיצד גלים אלה מתפתחים במרחב ובזמן ונותנים הבנה אינטואיטיבית לתופעות של התאבכות בונה והורסת של גלים אלה.

מחקר
הפענוח עשוי לסייע רבות בהרחבת היבולים החקלאיים וההתמודדות עם משבר המזון העולמי

מחקר בינלאומי ורב-תחומי בהובלת פרופ' אילון שני והדוקטורנט ג'ניה ביננבאום מבית הספר למדעי הצמח ואבטחת מזון באוניברסיטת תל אביב, חשף את מנגנון פעולתו ותנועתו בצמח של ההורמון ג'יברלין – חומר בעל חשיבות עצומה לגדילת יבולים חקלאיים. המחקר המורכב כלל עשרות ניסויים במגוון רחב של תחומים: פיזיולוגיה, ביולוגיה מולקולרית, ביוכימיה, מודלים מתמטיים, מיקרוסקופיה פלואורסנטית, גנטיקה ועוד. הניסויים בוצעו במהלך 7 שנים על ידי מספר קבוצות מחקר ברחבי העולם – באוניברסיטת תל אביב, במכון ויצמן למדע ובמכון וולקני בישראל, וכן בדנמרק, צרפת, אנגליה, גרמניה וספרד. המחקר פורץ-הדרך פורסם בכתב העת היוקרתי Nature Plants.
"מעטים מחוץ לקהילה המדעית שמעו על ההורמון ג'יברלין, אך למעשה זהו אחד החומרים בעלי ההשפעה הגדולה ביותר על האנושות," אומר פרופ' שני. "מדובר בהורמון, מולקולת סיגנל קטנה, שמבקר את גדילתם של הצמחים, והוא קשור ישירות למהפכה הירוקה של שנות ה-60 וה-70, שייעלה את העבודה החקלאית והגדילה באופן משמעותי את יבולי הדגניים – חיטה, שעורה, תירס ואורז. למעשה, טכניקות של מניפולציה בג'יברלין בצמחים הן אחד הגורמים העיקריים לכך שיש לנו היום מספיק אוכל בעולם. אך על אף חשיבותו, מעט מאוד היה ידוע עד לאחרונה על מנגנון פעולתו ותנועתו של הג'יברלין במרחב הצמח. במחקר הנוכחי יצאנו למסע מקיף על מנת לתת מענה לכמה שאלות מהותיות: איך נע הג'יברלין בתוך הצמח? איפה הוא מצטבר? ואיך בדיוק הוא פועל בתאים ספציפיים בצמח?"
המחקר בוצע בצמח ארבידופסיס (תודרנית לבנה) המשמש כצמח מודל במחקרים רבים. בשלב הראשון ביקשו החוקרים לזהות את המנגנון שמוביל את הג'יברלין מהעלים שבהם הוא נוצר, דרך מערכת ההובלה המכונה שיפה, אל השורש. לצורך כך הם יצרו בצמחים מוטציות שונות וביצעו בהם סריקות גנטיות, וכך גילו שלושה חלבונים נשאים (טרנספורטרים) שבלעדיהם הג'יברלין אינו מגיע ליעדו. מדובר בחלבונים שנמצאים בתאי השיפה, ופועלים יחדיו כדי להעביר את מולקולת הג'יברלין מצד אחד של קרום התא לצד השני, ובכך מאפשרים את מהלך מסעה הארוך לאורך הצמח כולו. במילים אחרות: תפקידם של חלבונים אלה הוא להטעין את הג'יברלין מן העלה אל רקמות ההובלה, שם הוא זורם במורד הצמח אל השורש.
בשלב הבא נעזרו החוקרים בשיטה מתקדמת של מיקרוסקופיה פלואורסנטית ברזולוציה של תא בודד כדי לבחון את השפעת הג'יברלין – או העדרו – על תאים בשורש. הם מצאו שהג'יברלין מצטבר בשכבת תאים בשורש שמכונה אנדודרמיס – שחוצצת בין רקמת ההובלה לשאר תאי השורש. ידוע שאחד מתפקידי האנדודרמיס הוא לבקר את מעבר החומרים שנקלטים על ידי השורש מן הקרקע (מים, מלחים, גזים וחומרי הזנה שונים) אל רקמות ההובלה המובילות חומרים אלה לשאר חלקי הצמח. בקרה זו נעשית על ידי ייצור שכבת בקרה - חומר איטום דמוי שעם שנקרא סוּבֶּרין. במחקר זה גילו החוקרים שבהיעדר ההורמון ג'יברלין נפגע ייצור הסוברין. בשורה התחתונה: הג'יברלין אחראי על בקרת ייצור הסוברין באנדודרמיס, ובכך הוא משפיע ישירות על הזנת הצמח ועל גדילתו.
״עד כה היה ידוע כי תנועת ההורמון ג׳יברלין בצמח הכרחית להתפתחות תקינה של הצמח, אך המנגנון שמאפשר תנועה זו לא היה ידוע," מסביר ד״ר ביננבאום. "במחקר שלנו פענחנו את המערכת שמאפשרת מעבר של ג׳יברלין בין חלקי הצמח השונים, וכן גילינו תפקיד חדש של הג'יברלין: בקרה על ייצור סוברין, חומר בעל חשיבות רבה להתפתחות הצמח. הבנת מנגנוני התנועה של ג׳יברלין בצמח עשויה להוות בסיס למחקר יישומי בעתיד, עם השפעה משמעותית על ביטחון תזונתי ועל התפתחות הצמח בסביבה משתנה.״
פרופ' שני מסכם: "במחקר רב-תחומי ממושך ומורכב הצלחנו לחשוף את מנגנוני תנועתו ופעולתו של אחד החומרים החשובים ביותר להזנת האנושות: ההורמון ג'יברלין. מצאנו כיצד הג'יברלין מגיע מהעלים לשורש, היכן הוא מצטבר בשורש, ואיך הוא משפיע משם על מנגנוני הזנת הצמח. אנו מקווים ומאמינים שהתובנות העולות מהמחקר יסייעו לפיתוחן של שיטות חדשניות להשבחת ולהגדלת יבולים, בעיקר דגניים, במטרה להתמודד עם אחד האתגרים הגדולים ביותר של העידן הנוכחי: הזנת מספרים הולכים וגדלים של בני אדם בתנאי אקלים משתנים."

מחקר
צוות המחקר מקווה שהכלים שפותחו במחקר זה יסללו את הדרך לפיתוח טיפולים דומים במחלות נדירות אחרות

חוקרים באוניברסיטת תל אביב פיתחו טיפול גנטי חדשני שעשוי לסייע לילדים הסובלים מתסמונת דרווה - אפילפסיה התפתחותית קשה הנובעת ממוטציה שאינה מועברת בתורשה מההורים, אלא מתרחשת באופן אקראי בעובר, בגן שנקרא SCN1A. התסמונת מתבטאת באפילפסיה קשה שאינה מגיבה לתרופות, לצד עיכוב התפתחותי, פגיעה קוגניטיבית וסיכוי גבוה למוות מוקדם.
המחקר נערך בהובלת ד"ר מורן רובינשטיין והסטודנטית סג׳א פדילה, מבית הספר לרפואה ומבית ספר סגול למדעי המוח, וד"ר אריק קרמר, מאוניברסיטת מונפלייה בצרפת. עוד השתתפו במחקר: ענת מבשוב, מרינה ברוזל וקרן אנדרסון מבית הספר לרפואה ומבית הספר סגול למדעי המוח באוניברסיטת תל אביב, וחוקרים נוספים מצרפת, מארה"ב ומספרד. המאמר פורסם בכתב העת Journal of Clinical Investigation.
"תסמונת דרווה, ששכיחותה בערך אחת ל-16,000 לידות, נחשבת לנפוצה יחסית בין המחלות הגנטיות הנדירות. נכון להיום, חיים בישראל כ-75 ילדים הסובלים מדרווה. מדובר באפילפסיה התפתחותית קשה, שמתחילה בפרכוסי חום סביב גיל חצי שנה, ומתקדמת, לאחר גיל שנה, להתקפים אפילפטיים ספונטניים תכופים לצד עיכוב התפתחותי מוטורי וקוגניטיבי", מסבירה ד"ר רובינשטיין.
לדבריה, התרופות הקיימות לאפילפסיה אינן מסייעות במידה מספקת לילדים עם דרווה, והם מצויים בסיכון משמעותי למוות מוקדם. ידוע שהתסמונת הקשה נובעת ממוטציה גנטית שאינה עוברת בתורשה מההורים, אלא נוצרת באופן אקראי בעובר בגן שנקרא SCN1A. בנוסף, המחלה אינה מאפיינת מגזר מסוים באוכלוסייה, לא ניתן לצפות אותה מראש, וגם לא לגלותה במהלך ההיריון.
לדברי החוקרים, כיום מקובל לבצע אנליזה גנטית לילדים שסובלים מפרכוסי חום מורכבים סביב גיל חצי שנה. "עם זאת, גם אם הבדיקה מזהה שהבעיה היא בגן SCN1A, האבחנה הסופית ניתנת לרוב לאחר החמרת האפילפסיה - הופעת פרכוסים ספונטניים קשים ועיכוב התפתחותי", הם אומרים.
בעיה נוספת שמעלים החוקרים היא כי "למרות שיש חשיבות רבה לאבחון המוקדם, לעיתים קרובות האבחנה מתעכבת, ולרוב הילדים מאובחנים רק בגיל שנה או שנתיים ולעיתים אף מאוחר יותר. טיפולים גנטיים שפותחו בעת האחרונה נמצאו יעילים בעכברים במודל לדרווה, וחלקם אף נמצאים כעת בשלב הניסויים הקליניים בבני אדם. אולם, טיפולים אלה הראו יעילות בעכברי מודל רק כאשר ניתנו בשלבים מוקדמים מאוד, עוד לפני הופעת התסמינים. מכיוון שטיפול גנטי הוא הליך מורכב ופולשני, הוא לא יינתן לילדים ללא אבחון ודאי. לכן במחקר זה, תוך התחשבות בגיל בזמן האבחנה הסופית, התרכזנו בפיתוח טיפול שיהיה יעיל לאחר הופעת הפרכוסים, ואף בגיל מאוחר יותר. בנוסף, מאחר שהתסמונת כוללת גם עיכוב התפתחותי, ביקשנו לפתח טיפול שיקל הן על האפילפסיה והן על התסמינים הקוגניטיביים".
"בטיפולים גנטיים נהוג להיעזר בנגיפים כנשאים המובילים חומר גנטי תקין לתוך גופו של החולה, על מנת שיתווסף ל-DNA הפגום ויאפשר פעילות תקינה. לצורך זה מהנדסים את הנגיף: מוציאים ממנו את החומר הגנטי המקורי שלו כדי שלא יוכל לגרום למחלה או לשכפל את עצמו, ובמקום זאת אורזים בתוכו את הגן התקין הרלוונטי. במקרה של תסמונת דרווה, מדובר בגן SCN1A שהוא גן גדול מאוד, ולכן ולא ניתן היה להשתמש בנגיפים נפוצים המשמשים בדרך כלל למטרה זו, והיה צורך בנגיף שמסוגל לשאת ולהעביר גנים גדולים. במחקר שלנו פתרנו את הבעיה על ידי שימוש בנגיף בשם Canine adeno virus type 2, כנשא של הגן התקין", מסבירה ד"ר רובינשטיין.

ד"ר מורן רובינשטיין
במסגרת המחקר, טופלו עכברי מודל בנגיף הנושא גן SCN1A תקין, והטיפול נמצא יעיל במגוון היבטים קריטיים: שיפור באפילפסיה, הגנה ממוות מוקדם, ותיקון משמעותי של היכולות הקוגניטיביות.
בשלב הבא הזריקו החוקרים את הנגיף הנשא למספר אזורים במוחם של עכברי המודל על מנת שידביק את תאי העצב הפגועים. 31 עכברים טופלו בגיל 3 שבועות, לאחר הופעת הפרכוסים הספונטניים (מקביל לגיל שנה עד שנתיים אצל ילדים חולים), ו-13 עכברים טופלו בגיל 5 שבועות (מקביל בערך לגיל 6 עד 8 אצל ילדים). בנוסף, הוזרק נגיף ריק למוחם של 48 עכברים לצורך בקרה.
התוצאות היו מבטיחות. היעילות הגבוהה ביותר נצפתה בהזרקת הטיפול בגיל 3 שבועות. בעכברים אלה, הפרכוסים פסקו לחלוטין בתוך 60 שעות בלבד מההזרקה, תוחלת החיים עלתה משמעותית, והפגיעה הקוגניטיבית (שאובחנה באמצעות מבחני זיכרון מרחבי), תוקנה באופן מלא.
גם בעכברים שטופלו בגיל 5 שבועות נצפה שיפור משמעותי, שהתבטא בירידה בפעילות האפילפטית ובהגנה מפרכוסי חום. בעכברי קבוצת הביקורת שקיבלו נגיף ריק, לא נצפה כל שיפור והם סבלו מתסמיני המחלה ממש כמו עכברים שלא טופלו כלל, וכ-50% מהם מתו מוות מוקדם כתוצאה האפילפסיה הקשה. בנוסף הוזרק הטיפול לעכברים בריאים ולא גרם להם כל נזק – הוכחה לבטיחותו.
"הטיפול שלנו הוסיף לתאי העצב הפגועים במוח גן תקין, שהספיק בכדי להחזירם לתפקוד נורמלי. החזרת הגן התקין בשלמותו חשובה במיוחד בתסמונת דרווה, מכיוון שבילדים שונים המוטציה מתרחשת במקומות שונים בגן, והגן השלם מהווה טיפול יחיד המתאים לכל החולים. בנוסף, מצאנו שהנגיף שנבחר לצורך המחקר מדביק תאי עצב רבים במוח, ומתפזר באופן נרחב מעבר למקום ההזרקה״, מסבירים החוקרים.
"הטיפול שפיתחנו הוא הראשון שהוכח כיעיל עבור תסמונת דרווה כשהוא ניתן לאחר תחילת הפרכוסים הספונטניים, והראשון שהביא לשיפור בתפקוד הקוגניטיבי של עכברי המודל. רשמנו עליו פטנט, ואנחנו מקווים שבעתיד הוא יגיע לקליניקה ויסייע לילדים שסובלים מהמחלה הקשה. בנוסף, אנחנו בוחנים כעת אם הוא עשוי להתאים גם למחלות נוירו-התפתחותיות גנטיות אחרות. הפלטפורמה שפיתחנו היא פלטפורמת Plug & play לטיפולים גנטיים, ואולי בעתיד נוכל לארוז בנגיף הנשא גם חומר גנטי תקין מסוג אחר, לטיפול במחלות נוספות", מסכמת ד"ר רובינשטיין.